Die Krankheit „Tuberöse Sklerose Complex“ (TSC) betrifft etwa eins bis zwei von 10.000 Neugeborenen. Bei dieser genetisch bedingten Erkrankung kommt es zur Bildung gutartiger Tumore. Diese können die Funktionsweise von lebenswichtigen Organen wie Niere, Lunge und Gehirn massiv beeinträchtigen. Dabei sind verschiedene Patienten unterschiedlich schwer betroffen. Auslöser für die Erkrankung sind Mutationen in einem von zwei Genen (TSC1- oder TSC2-Gen).
Ein interdisziplinäres Forscherteam um die Biochemiker Prof. Dr. Daniel Kümmel und Dr. Andrea Oeckinghaus von der Westfälischen Wilhelms-Universität (WWU) Münster hat das „Tumorsuppressor-Protein“ TSC1 untersucht und erstmals Einblicke in seine bisher unklare Funktionsweise gewonnen. Das Team hat einen neuen Mechanismus in einem zentralen zellulären Prozess identifiziert, der die Zellteilung und das Zellwachstum reguliert. Die Erkenntnisse können auch helfen, die Entstehung der Tuberösen Sklerose zu verstehen. Die Ergebnisse der Studie sind nun in der Fachzeitschrift Molecular Cell (online vorab) veröffentlicht.
Mutationen betreffen einen „Kletten-Effekt“
Das TSC1-Protein bildet zusammen mit dem TSC2-Protein den TSC-Proteinkomplex. Dessen Aufgabe ist es, das Zellwachstum zu kontrollieren und damit auch das Entstehen von Tumoren zu unterdrücken, daher die Bezeichnung „Tumorsuppressor“. Welche Funktionen TSC1 dabei übernimmt, war bisher größtenteils unklar. Ebenso wenig bekannt war der Mechanismus, der bei der Entstehung der Erkrankung durch bestimmte Mutationen im TSC1-Gen betroffen ist. Die Wissenschaftler fanden jetzt heraus, dass ein Teil des TSC1-Proteins, eine sogenannte Domäne, an Membranoberflächen der Lysosomen binden kann. Lysosomen sind kleine, von einer Membran umhüllte Bläschen im Inneren der Zelle, die Verdauungsenzyme enthalten. Auf ihrer Oberfläche liegen bestimmte Schaltstellen. Diese Schaltstellen sind für die Regulation des Zellwachstums wichtig. Das TSC1-Protein sorgt dafür, dass der gesamte TSC-Komplex an diese Schaltstellen gelangt und dort ein unkontrolliertes Zellwachstum verhindert, indem es die Aktivität eines wichtigen Signalproteins – fachsprachlich „mTOR“ genannt – hemmt (die Abkürzung steht für „Mechanistic Target of Rapamycin“).
„TSC1 nutzt dabei eine Strategie, die an das Prinzip einer Klette erinnert“, erläutert Daniel Kümmel. Die einzelnen Häkchen der Klette binden schwach an einen Stoff, aber viele Haken zusammen sorgen für festen Halt.“ Die Studien zeigen, dass auch die einzelne Membranbindedomäne von TSC1 nur schwach bindet. Dadurch jedoch, dass es zu einer kontrollierten Zusammenlagerung von vielen TSC1-Molekülen kommt, wird die starke Bindung ermöglicht. „In der Membranbindedomäne kommen besonders häufig Mutationen vor. Wir gehen davon aus, dass sich ein Teil der pathogenen Effekte durch einen Verlust der korrekten Lokalisation des TSC-Komplexes nun erklären lässt“, unterstreicht Andrea Oeckinghaus.
Membranbestandteil reguliert Zellwachstum
Eine weitere Erkenntnis ist, dass die Beschaffenheit der Membranoberfläche die Funktionsweise des TSC-Komplexes beeinflussen kann – und somit auch die Wachstumsprozesse der Zelle. Genauer gesagt, identifizierte das Team einen speziellen Bestandteil der Membran: ein besonderes Lipid mit dem Namen Phosphatitylinisitol-3,5-bisphostphat (PI3,5P₂), das für die die Aktivität des TSC-Komplexes nötig ist. Je nachdem, wie häufig es auf der Membranoberfläche vorkommt, wirkt sich das unterschiedlich auf die Aktivität aus. „Da die Produktion und der Abbau dieses Lipids reguliert werden, eröffnet sich eine ganz neue Perspektive darauf, wie das Zellwachstum kontrolliert werden kann. Unsere Ergebnisse sind daher auch ein spannender Startpunkt für weiterführende Studien“, sagt Daniel Kümmel.
Das Forscherteam setzte für die Untersuchungen ein breites Methodenspektrum ein, ausgehend von strukturbiologischen und biochemischen Ansätzen hin zu zellbiologischen Experimenten. „Der daraus resultierende umfassende Einblick in mechanistische und physiologische Aspekte war nur durch eine interfakultäre Kooperation möglich“, unterstreicht Daniel Kümmel.
Die Arbeit wurde von den Arbeitsgemeinschaften von Dr. Andrea Oeckinghaus (Medizinische Fakultät der WWU und Universitätsklinikum Münster, Institut für Molekulare Tumorbiologie) und Prof. Dr. Daniel Kümmel (Fachbereich Chemie und Pharmazie der WWU, Institut für Biochemie) durchgeführt. Beiträge haben zudem Kooperationspartner vom Kölner Max-Planck-Institut für Biologie des Alterns und vom Max-Planck-Institut für molekulare Physiologie aus Dortmund beigesteuert.
Förderung
Die Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG) finanziell gefördert.
Originalpublikation
Katharina Fitzian, Anne Brückner, Laura Brohée, Reinhard Zech, Claudia Antoni, Stephan Kiontke, Raphael Gasper, Anna Livia Linard Matos, Stephanie Beel, Sabine Wilhelm, Volker Gerke, Christian Ungermann, Mark Nellist, Stefan Raunser, Constantinos Demetriades, Andrea Oeckinghaus, Daniel Kümmel (2021): TSC1 binding to lysosomal PIPs is required for TSC complex translocation and mTORC1. Molecular Cell; DOI: 10.1016/j.molcel.2021.04.019
WWU Münster (upm)
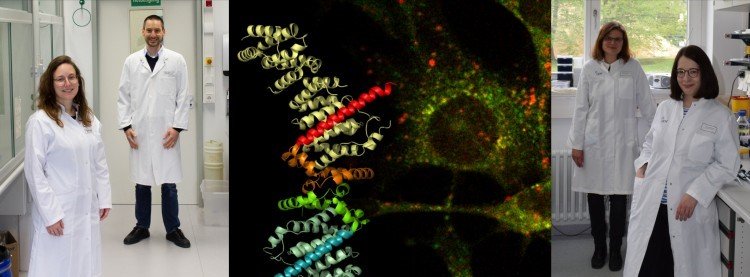
Foto: AG Kümmel/AG Oeckinghaus. Dr. Katharina Fitzian und Prof. Dr. Daniel Kümmel sowie Dr. Andrea Oeckinghaus und Anne Brückner (v. l.) in ihren Laboren. Die Kollage in der Mitte illustriert die Struktur der TSC1-Membranbindedomäne (links) neben einer fluoreszenzmikroskopischen Aufnahme, die die Lokalisation des TSC-Komplexes (rot) in Zellen zeigt.