Untersuchungen an den
„Schaltern“ der Gewichtsregulation sind aktueller denn je. Es gilt
Erkrankungen zu behandeln, bei denen genetische Defekte zu einem
Ausbleiben des Sättigungsgefühls und in der Folge einer ausgeprägten,
schwer behandelbaren Fettleibigkeit bereits in jungen Jahren führen.
Gleichzeitig ist Übergewicht eines der drängenden globalen Probleme.
Schätzungsweise 1,6 Milliarden Erwachsene und 650 Millionen Kinder sind
momentan weltweit übergewichtig. Damit einher geht ein erhöhtes Risiko
für Folgeerkrankungen wie Herz-Kreislauf-Fehlfunktionen oder Diabetes
mellitus. Stetig steigende Zahlen und langfristige Konsequenzen treiben
Forschende weltweit an, die Mechanismen der Appetitregulation auf
molekularer und letztendlich atomarer Ebene zu entschlüsseln. Im Fokus
des Interesses stehen die Auswirkungen genetischer Defekte auf Appetit
und Hungergefühl wie auch die Suche nach möglichen Stellen, an denen im
Krankheitsfall medikamentös eingegriffen werden kann.
In der
nun vorliegenden Studie widmet sich das Team um Dr. Patrick Scheerer,
Leiter der Arbeitsgruppe Proteinstrukturanalyse und Signaltransduktion
am Institut für Medizinische Physik und Biophysik der Charité, einem
zentralen Player im Prozess der Regulation des Hungergefühls und damit
der Gewichtsregulation des Menschen. Es handelt sich um ein vorwiegend
im Gehirn lokalisiertes Protein, das von Hormonen reguliert wird, die
durch ein Andocken an das Protein entscheidende Signale für das
Sättigungsgefühl auslösen. Solche Proteine werden allgemein Rezeptoren
genannt – in diesem Fall ist es der Melanocortin-4-Rezeptor (MC4R).
Seine Aktivierung durch stimulierende Hormone (α-/ß-MSH) hemmt das
Hungergefühl. Gegenregulator ist das sogenannte Agouti-related peptide
(AgRP), es blockiert den Rezeptor und führt zu einem vermehrten
Hungergefühl. Genetisch bedingte Fehlfunktionen an diesem
„Schalter“-Protein führen bei Menschen sehr häufig zu leichtem oder
schwerem Übergewicht. Prof. Dr. Peter Kühnen, Mediziner und
Wissenschaftler am Institut für Experimentelle Pädiatrische
Endokrinologie, ist auf die Behandlung von Patientinnen und Patienten
spezialisiert, bei denen aufgrund von Gendefekten das Sättigungsgefühl
unzureichend übermittelt wird. Auf der Suche nach
Behandlungsmöglichkeiten für diese Formen der Adipositas hat sich der
Endokrinologe intensiv mit den Signalketten der menschlichen
Gewichtsregulation befasst, Mutationen in für Botenstoffe und Rezeptoren
zuständigen Genen untersucht und mögliche Wirkstoffe analysiert, die
einzelne Botenstoffe ersetzen können.
Die Hürde bei einer
medikamentösen Behandlung von pathologischem erhöhten Appetit: „Bisher
sind diese pharmakologischen Interventionen von Nebenwirkungen
begleitet. Diese reichen von einer Dunkelfärbung der Haut – das
Melanocortin-Hormon ist unter anderem auch für die Pigmentierung von
Haut und Haaren zuständig – bis hin zu kardiovaskulären Ereignissen“,
sagt Prof. Kühnen, der auch an der aktuellen Untersuchung mitgewirkt hat
und für seine Forschungsleistungen zur Entwicklung neuer,
nebenwirkungsärmerer Medikamente mit dem Paul-Martini-Preis
ausgezeichnet worden ist. „Die Ursache dieser unerwünschten Wirkungen
liegt im Aufbau der vorhandenen Medikamente“, erklärt Studienleiter Dr.
Scheerer. „Diese adressieren in der Regel nicht nur ein Ziel, sondern
verschiedene Rezeptoren aus der gleichen Familie, die aber eine andere
Rolle im Organismus spielen. Je genauer wir die Interaktionen zwischen
den beteiligten Komponenten kennen, umso gezielter lässt sich
eingreifen.“ Im Sinne der Translation, dem Übertragen wissenschaftlicher
Erkenntnisse in die medizinische Praxis, arbeiten die Gruppen um Dr.
Scheerer und Prof. Kühnen an der Charité eng zusammen, auch ergänzen sie
sich im Rahmen des übergeordneten DFG-Sonderforschungsbereichs (SFB)
1423 „Structural Dynamics of GPCR Activation and Signaling“ der
Universität Leipzig, an dem die Charité mit vier Teilprojekten beteiligt
ist.
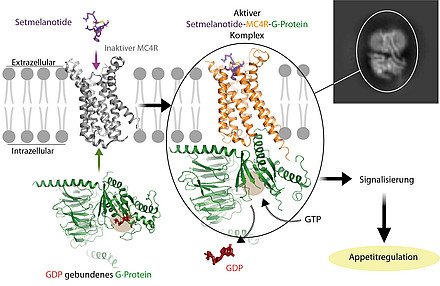
Im Zuge der aktuellen Arbeiten ist es gelungen, die
räumliche Struktur des Hormon-Rezeptors MC4R, einem
G-Protein-gekoppelten Rezeptor (GPCR), aufzuklären und sichtbar zu
machen. Hierfür reichen herkömmliche optische Methoden nicht aus, denn
das Protein ist in Nano-Größenordnungen angesiedelt, also winzig klein.
„Wir konnten mittels Kryo-Elektronenmikroskopie, einem hochmodernen
Verfahren der Bildgebung, die dreidimensionale Struktur des Rezeptors –
im Bereich von 0,26 Nanometer – auflösen und darstellen“, sagt Nicolas
Heyder, Wissenschaftler am Institut für Medizinische Physik und
Biophysik und Erstautor der Studie. „Dabei haben wir den aktiven
Rezeptor in zwei Komplexen mit einem Haupteffektor, dem G-protein, der
im Inneren der Zelle an den Rezeptor gebunden ist, abgebildet. Die
beiden Komplexe unterscheiden sich durch zwei gebundene Hormonvarianten:
Setmelanotide und NDP-α-MSH, zwei Wirkstoffe, die in den letzten beiden
Jahren als Medikamente zugelassen wurden und die jeweils von einem
winzigen Calcium-Ion stabilisiert werden.“ Es hat sich gezeigt, dass
beide Rezeptorstrukturen Unterschiede in sehr kleinen, aber wichtigen
Punkten hinsichtlich der Bindung der Wirkstoffe und des G-Proteins
aufweisen. „Diese molekularen Details geben wichtige Hinweise darauf,
warum und wie genau verschiedene Liganden, also Informationsmoleküle,
die unterschiedlichen Signalwege des MC4R spezifischer beeinflussen. Für
eine pharmakologische Intervention ist das von großer Bedeutung“,
erklärt Nicolas Heyder.
Voraussetzung für eine solche
Basisarbeit zu kleinsten Zellbestandteilen war neben dem Einsatz der
Kryo-Elektronenmikroskopie ein langjähriges Etablieren der
Proteinherstellung und -expression in Zellkulturen. Beides wurde an der
Charité in Kooperation mit weltweit führenden Laboren und Experten
stetig optimiert, unter ihnen Chemie-Nobelpreisträger Brian Kobilka,
Professor an der Stanford University School of Medicine und Einstein
Visiting Fellow am Berlin Institute of Health (BIH) in der Charité. Im
Ergebnis beschreibt die Studie präzise bislang unbekannte Details in der
Funktionsweise des Melanocortin-4-Rezeptors – wie er aktiviert, oder
aber blockiert wird und wie ein Hormon jeweils mit dem Rezeptor-Protein
interagiert und dadurch ein Signal innerhalb der Zelle auslöst. „Wir
erkennen jetzt kleinste Unterschiede im Zusammenspiel von
Rezeptor-Hormonvarianten, die wichtig sein können, um neue Medikamente,
deren Einsatz mit Nebenwirkungen einherging, weiter zu verbessern“, sagt
Dr. Scheerer. „Die genaue Struktur der Hormonbindungstasche ist nun
bekannt und kann gezielt adressiert werden.“ Das ist ein Schlüssel im
translationalen Verständnis zwischen endokrinologischen Aspekten, hier
der Hormonregulation, und den strukturellen Eigenschaften
zusammenspielender Proteine.
Insbesondere konnte das
Forschungsteam aufzeigen, wie sich ein bereits vor der Untersuchung
bekannter, den Rezeptor inaktivierender Regulator – ein Antagonist – in
seiner Bindung im Wesentlichen an nur einer Stelle vom aktivierenden
Agonisten unterscheidet, sonst aber fast identisch gebunden ist. „Dieser
Unterschied deutet sehr genau darauf hin, an welcher Stelle der
Rezeptor blockiert werden kann und wo eine sensible Schalterstelle für
die Aktivierung des Proteins lokalisiert ist“, so Dr. Scheerer. In
künftigen Arbeiten wollen die Forschenden noch mehr über das System mit
MC4R im Zentrum herausfinden und damit Ansatzpunkte für eine gezielte
Beeinflussung. So gilt es nun zu verstehen, wie der Rezeptor auf
molekularer Ebene durch zusätzliche Einflüsse gesteuert wird. Einige
direkt interagierende Faktoren sind bereits bekannt, nicht bekannt
dagegen ist, wie sie auf das Zusammenspiel einwirken.
*Heyder N et al. Structures of active melanocortin-4 receptor–Gs-protein complexes with NDP-α-MSH and setmelanotide. Cell Research (2021) 0:1–14; 24.September; DOI: 10.1038/s41422-021-00569-8
Über die Studie
Ermöglicht wurden die Untersuchung durch die Deutsche
Forschungsgemeinschaft (DFG) im SFB1423 „Structural Dynamics of GPCR
Activation and Signaling“. Weitere Unterstützung erhielten die Arbeiten
durch das Exzellenzcluster Unifying Systems in Catalysis (UniSysCat),
den SFB1365 (DFG) und das Berlin Institute of Health (BIH) in der
Charité.
Charité – Universitätsmedizin Berlin