Die meisten Lebewesen haben eine innere Uhr, die unter anderem den Schlaf-wach-Rhythmus steuert. Der innere Rhythmus dauert ungefähr einen Tag („zirkadian“), also etwa 24 Stunden, und wird durch verschiedene „Uhr-Gene“ getaktet. Außerdem erfolgt ein permanenter Abgleich mit Faktoren wie Licht und Temperatur, um die innere Uhr mit dem äußeren Tag-Nacht-Rhythmus zu synchronisieren. Ein Team um den Neurobiologen Prof. Dr. Ralf Stanewsky von der Westfälischen Wilhelms-Universität (WWU) Münster wies nun bei der Taufliege Drosophila melanogaster nach, dass ein bestimmtes Ionen-Transportprotein („KCC“) bei der Steuerung des zirkadianen Rhythmus durch Licht eine Rolle spielt.
Das untersuchte Ionen-Transportprotein ist Teil einer molekularen Signalkaskade in bestimmten Hirnneuronen. Zum Hintergrund: An der Steuerung der inneren Uhr der Taufliege ist ein Protein mit der Bezeichnung „Quasimodo“ beteiligt. Es ist Teil der Zellmembran und trägt dazu bei, Lichtsignale als Taktgeber von außen weiterzugeben und eine innere molekulare Steuerungskaskade auszulösen. Quasimodo interagiert mit einem Natrium-Kalium-Chlorid-Cotransporter namens NKCC. Dessen Aufgabe ist es, Chlorid-Ionen in die Zelle hineinzuschleusen. In der aktuellen Studie, die im Fachmagazin „Current Biology“ veröffentlicht wurde, untersuchten die Forscher nun erstmals den Gegenspieler von NKCC, nämlich den Kalium-Chlorid-Cotransporter KCC, der Chlorid-Ionen aus der Zelle herausschleust.
Das Gleichgewicht dieser beiden Co-Transporter bestimmt den Chlorid-Gehalt in der Zelle. Und der wiederum ist entscheidend für das Funktionieren der inneren Uhr: Der Chloridgehalt legt fest, wie ein Neuron auf den Neurotransmitter GABA reagiert. Bei hohem Chloridgehalt wirkt GABA anregend, bei niedrigem hemmt er die Signalweitergabe durch die Zelle. „Das gleiche Signal kann also anregend oder hemmend wirken“, erläutert Erstautorin Katharina Eick. „Man vermutet, dass es zum Beispiel von der Tageszeit abhängt – es könnte unterschiedliche Verhaltensweisen der Fliege bei Tag und Nacht erklären.“ Die Aktivität der Cotransporter wird durch zwei Enzyme, die Kinasen „Wnk“ und „Fray“, reguliert. Auch diese beiden Kinasen nahmen die Forscher unter die Lupe.
 „Interessant ist, dass die beiden Cotransporter NKCC und KCC
sowie die Kinasen Wnk und Fray evolutionär betrachtet sehr alte Proteine sind,
die nicht nur in Fliegen, sondern auch in Säugetieren vorkommen“, unterstreicht
Katharina Eick. „Es war von Säugetieren, nicht aber von Fliegen, schon bekannt,
dass die Aktivität von NKCC und seinem Gegenspieler eine wichtige Rolle bei der
inneren Uhr spielt.“
„Interessant ist, dass die beiden Cotransporter NKCC und KCC
sowie die Kinasen Wnk und Fray evolutionär betrachtet sehr alte Proteine sind,
die nicht nur in Fliegen, sondern auch in Säugetieren vorkommen“, unterstreicht
Katharina Eick. „Es war von Säugetieren, nicht aber von Fliegen, schon bekannt,
dass die Aktivität von NKCC und seinem Gegenspieler eine wichtige Rolle bei der
inneren Uhr spielt.“
Die Ergebnisse der Studie im Detail: Das Team wies nach, dass Fliegen, bei denen jeweils eine der drei untersuchten Stellschrauben besonders aktiv oder inaktiv ist, ein abnormales rhythmisches Verhalten bei konstantem Licht zeigen. Normalerweise haben Fliegen bei konstanter Beleuchtung keinen Verhaltensrhythmus, da ein essenzielles Protein der molekularen Uhr im Licht abgebaut und somit die Funktion der Uhr gestört wird. „Aus unserem Experiment können wir schließen, dass KCC, Wnk und Fray an einem Signalweg beteiligt sind, durch den Lichtreize an die innere Uhr übertragen werden“, unterstreicht Katharina Eick.
Neben dem abnormalen rhythmischen Verhalten im konstanten Licht bemerkten die Forscher bei manchen Fliegen, die einem langen Tag-Nacht-Zyklus ausgesetzt waren (16 Stunden hell, acht Stunden dunkel), eine weitere Verhaltensauffälligkeit: eine abnormal erhöhte Aktivität am Morgen. Diese erhöhte Aktivität trat nur auf, wenn jeweils weniger NKCC und Quasimodo vorhanden waren als normal. „Die Ergebnisse deuten darauf hin, dass die von uns untersuchten Proteine eine Funktion bei der Anpassung der zirkadianen Uhr an die verschiedenen Jahreszeiten mit unterschiedlicher Tageslänge haben könnten. Hierzu gibt es auch bereits Hinweise bei Säugetieren“, sagt Katharina Eick. Das Team wies außerdem erstmals nach, dass das Ionen-Transportprotein KCC die neuronale Antwort auf den Neurotransmitter GABA in der inneren Uhr der Fliegen direkt beeinflussen kann.
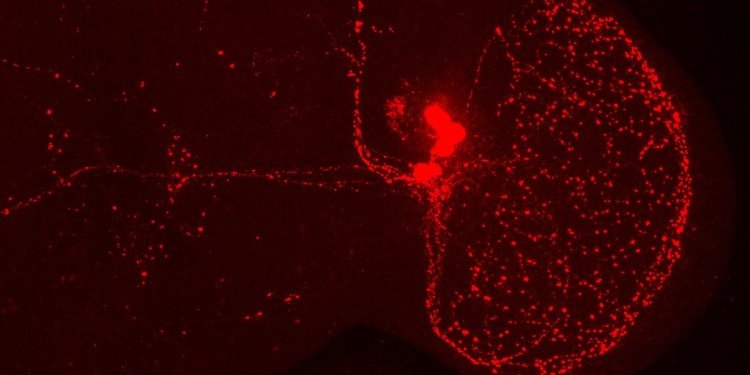
Zu den Methoden: Die Forscher setzten eine Kombination aus Verhaltensexperimenten, Elektrophysiologie und modernen genetischen Methoden ein. Durch zellspezifische genetische Manipulation erzeugten sie Fliegenstämme, bei denen die untersuchten Proteine besonders viel, wenig oder gar nicht vorhanden waren. Die Aktivität der Hirnneuronen wurde an den sogenannten großen ventrolateralen Uhrneuronen im Gehirn der Taufliegen gemessen.
Neben dem münsterschen Team um Ralf Stanewsky waren Wissenschaftler der Universität Bristol, Großbritannien, an der Studie beteiligt. Die Deutsche Forschungsgemeinschaft (DFG) und der Biotechnology and Biological Sciences Research Council (BBSRC) förderten die Arbeit finanziell.
WWU
Blick in das Gehirn einer Taufliege. Das Gehirn wurde mit einem sogenannten PDF- (Pigment dispersing factor) Antikörper gefärbt. Rot: die ventrolateralen Uhrneuronen einer Hirnhälfte und ihre Nervenfortsätze./© WWU – AG Stanewsky