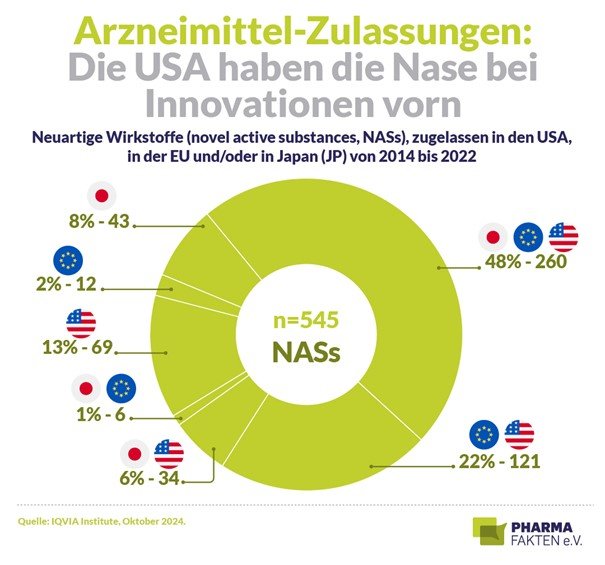
Insgesamt zählt das IQVIA Institute 545 innovative, neu zugelassene Wirkstoffe (NASs: novel active substances) für den Zeitraum von 2014 bis 2022. Viele davon seien „lebensrettende Therapien“, schreiben die Expert:innen in ihrem Report. Allein von 2019 bis 2023 machten Medikamente mit von der US-amerikanischen Behörde FDA vergebenen Orphan Drug-Status 54 Prozent aller neuen Arzneimittel aus – „was einen bedeutenden Fokus auf seltene Krankheiten erkennen lässt“. 48 Prozent waren zudem First-In-Class-Ansätze – sie stellen also Wirkmechanismen dar, die es so noch nie gegeben hat.
Umso tragischer ist die Tatsache, dass der Wohnort der Patient:innen mitbestimmt, ob sie Zugang zu den Innovationen erhalten. Von den 545 neuen Wirkstoffen sind nur rund die Hälfte (260 bzw. 48 %) von allen drei Behörden – also sowohl in den USA als auch in Europa und in Japan – zugelassen (s. Grafik). Spitzenreiter bei den NASs-Zulassungen sind die USA. Zumal zunehmend mehr Präparate ausschließlich in den Vereinigten Staaten zu bekommen sind (69 bzw. 13 %): Laut IQVIA Institute betrifft das besonders die Onkologie und Neurologie und bezieht sich oft auf (First-In-Class-)Wirkstoffe, die kleine Biopharma-Unternehmen entwickelt haben. Das zeige, dass es womöglich gerade für junge Firmen eine Herausforderung ist, internationale Prozesse zu durchlaufen.
- 380 der 545 Präparate wurden von 2014 bis 2022 in den USA zugelassen.
- 305 Zulassungen gab es in der EU.
- Japan kommt auf 301 neue NASs.
Die USA baue ihren Vorsprung Jahr für Jahr aus, heißt es. Zudem geht der Zulassungsprozess dort besonders schnell vonstatten: Im Schnitt geben die USA fast ein halbes Jahr vor der EU und fast drei Jahre vor Japan grünes Licht.
Arzneimittel-Verfügbarkeit: Viele Faktoren spielen eine Rolle
Übrigens: In Japan und in Deutschland dauert es im Median immerhin nur zwei Monate von Zulassung bis Marktverfügbarkeit. Dann folgen Dänemark (3 Monate) und die USA (4 Monate). Alle anderen EU-Länder sind deutlich langsamer, bis neue Präparate erstattbar sind – das Spektrum reicht von acht (Schweden) bis 56 Monate (Zypern). Das heißt: Eine Zulassung ist noch lang keine Garantie dafür, dass die Innovationen auch tatsächlich (zügig) ans Krankenbett gelangen.
Es ist wichtig zu untersuchen, warum es solch große Unterschiede gibt – schließlich steht die Gesundheit der Patient:innen und ihre bestmögliche Behandlung nach dem neuesten Stand der Medizin auf dem Spiel. Für Arzneimittelhersteller ist es scheinbar herausfordernder eine Zulassung in der EU und in Japan zu bekommen als in den USA, so das IQVIA Institute. Und auch danach wird es nicht einfach: Europa zum Beispiel gleicht einem Flickenteppich – jedes Land habe seinen eigenen Prozess, spezifische Hürden und Anforderungen, um neu zugelassene Medikamente in die Erstattungsfähigkeit und somit in die alltägliche Behandlungspraxis zu überführen.
Damit Patient:innen überall vom medizinischen Fortschritt profitieren
Beide, die EU und Japan, haben jüngst politische Reformen angekündigt, mit dem Ziel, den Zugang der Patient:innen zu verbessern“, schreiben die Autor:innen. Aktuell steche Deutschland in der EU hervor: Unmittelbar nach Zulassung sind Innovationen erstattbar – die Preisverhandlungen zwischen pharmazeutischen Unternehmen und Gesetzlicher Krankenversicherung finden nachgelagert statt, sodass nicht unnötig Zeit verloren geht. „Andere Länder in der EU könnten dieses System adoptieren“.
Dieser Vorschlag des Instituts zeigt, wie gut das hiesige Verfahren funktioniert. Noch: Das Ende 2022 in Kraft getretene GKV-Finanzstabilisierungsgesetz hat etablierte Regeln der Preisfindung aus den Angeln gehoben – in der Folge kam es bereits dazu, dass es Innovationen nicht in die Versorgung schafften. Hinzu kommt, dass das Verfahren dringend einige Nachbesserungen nötig hat. Denn es ist bald 15 Jahre alt und nicht auf die Innovationen von Heute – wie Gentherapien – angepasst. Auch in Deutschland ist also viel zu tun, damit Patient:innen weiterhin vom medizinischen Fortschritt profitieren können. Gleichzeitig gilt: Die USA eignen sich hier wenig als Vorbild. Weil es dort keine zentrale staatliche Krankenversicherung für alle Bürger:innen gibt, fallen viele Menschen durch das Raster – und können sich als Selbstzahler:innen die bestmögliche medizinische Behandlung unter Umständen nicht leisten.
pharma-fakten.de
Foto: IQVIA Institute
Alle Angaben ohne Gewähr.