Der Wirkstoff soll die rasante Vermehrung des SARS-CoV-2-Erregers in menschlichen Zellen unterdrücken, indem er die virale Kopiermaschine, die RNA-Polymerase, stoppt. Forschende vom Göttinger Max-Planck-Institut für biophysikalische Chemie und der Universität Würzburg haben nun aufgeklärt, warum Remdesivir die virale Polymerase während des Kopierens stört, sie aber nicht vollständig hemmt.
„Nach komplizierten Untersuchungen kommen wir zu einem einfachen Schluss“, sagt Max-Planck-Direktor Patrick Cramer. „Remdesivir behindert zwar die Polymerase in ihrer Arbeit, aber erst mit einiger Verzögerung. Und das Medikament stoppt das Enzym nicht vollständig.“
Cramers Team am MPI für biophysikalische Chemie hatte zu Anfang der Pandemie aufgeklärt, wie das Coronavirus sein RNA-Erbgut verdoppelt – für den Erreger eine echte Mammutaufgabe. Denn die Virus-RNA besteht aus einer Kette von rund 30.000 RNA-Bausteinen und ist damit besonders lang.
Um den Wirkmechanismus von Remdesivir aufzuklären, arbeitete Cramers Team mit Claudia Höbartners Gruppe zusammen, die spezielle RNA-Moleküle für die Struktur- und Funktionsuntersuchungen herstellte. „Remdesivir ähnelt in seiner Struktur RNA-Bausteinen“, erklärt Höbartner, Professorin für Chemie an der Universität Würzburg. Die Polymerase lässt sich davon in die Irre führen und baut die Substanz in die wachsende RNA-Kette ein.
Pausieren statt blockieren
Nach dem Einbau von Remdesivir in das Virus-Erbgut untersuchten die
Forscherinnen und Forscher die Polymerase-RNA-Komplexe mithilfe
biochemischer Methoden und der Kryo-Elektronenmikroskopie. Wie sie
herausfanden, pausiert der Kopiervorgang genau dann, wenn sich die
RNA-Kette nach Einbau von Remdesivir um drei weitere RNA-Bausteine
verlängert hat.
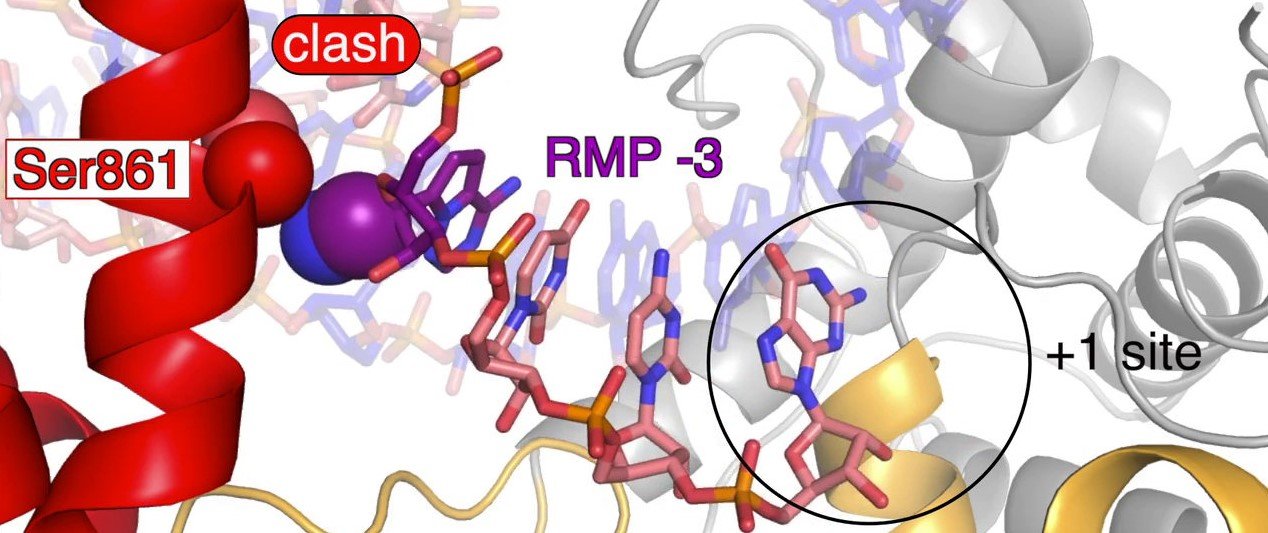
„Einen vierten Baustein lässt die Polymerase nicht mehr
zu. Das liegt an nur zwei Atomen in der Struktur von Remdesivir, die
sich an einer bestimmten Stelle der Polymerase verhaken. Allerdings
blockiert Remdesivir die RNA-Produktion nicht komplett. Oft arbeitet die
Polymerase nach einer Fehlerkorrektur auch weiter“, erläutert Goran
Kokic, wissenschaftlicher Mitarbeiter in Cramers Labor.
Gemeinsam mit
den anderen Erstautoren der Studie, Hauke Hillen, Dimitry Tegunov,
Christian Dienemann und Florian Seitz, führte er die entscheidenden
Experimente durch, die jetzt im Wissenschaftsjournal Nature Communications veröffentlicht wurden.
Zu verstehen, wie Remdesivir wirkt, eröffnet Wissenschaftlerinnen und Wissenschaftlern neue Chancen, das Virus zu bekämpfen. „Jetzt, da wir wissen, wie Remdesivir die Corona-Polymerase hemmt, können wir daran arbeiten, die Substanz und ihre Wirkung zu verbessern. Darüber hinaus wollen wir nach neuen Substanzen fahnden, die die virale Kopiermaschine stoppen“, so Max-Planck-Direktor Cramer. „Die jetzt angelaufenen Impfungen sind essenziell, um die Pandemie unter Kontrolle zu bringen. Aber wir müssen weiterhin auch wirksame Medikamente entwickeln, die im Fall von Infektionen den Krankheitsverlauf von Covid-19 mildern.“
Animation unter: https://s3-eu-west-1.amazonaws.com/www.mpg.de-streaming-eu/de/institute/mpibpc/Remdesivir_Supvid1_nointro-small.mp4
Quelle: Max Planck Gesellschaft (cr)
Foto: Hauke Hillen, Goran Kokic und Patrick Cramer / Max-Planck-Institut für biophysikalische Chemie
Das Covid-19-Medikament Remdesivir (violett) wird während des
Kopiervorgangs in die neue RNA-Kette eingebaut und unterdrückt die
Verdopplung des Corona-Erbguts.