Die Behandlung der Parkinson-Krankheit könnte künftig in eine neue Dimension vorstoßen. Ein Team um Forschende des Max-Planck-Instituts für Intelligente Systeme in Stuttgart hat in Mäusen gezeigt, dass sich Nervenzellen im Gehirn über Nanoelektroden drahtlos stimulieren lassen.
Bislang implantieren Ärztinnen und Ärzte Parkinsonpatienten zentimeterlange Elektroden für die tiefe Hirnstimulation. Das ist mit einer größeren neurochirurgischen Operation verbunden. Die Nanopartikel, die das Stuttgarter Team nun als Elektroden getestet hat, ließen sich dagegen bei einem vergleichsweise kleinen Eingriff in die entsprechenden Hirnregionen injizieren.
Mehr als sechs Millionen Menschen leiden weltweit an Parkinson. Die Krankheit ist damit nach Alzheimer die zweithäufigste neurodegenerative Erkrankung. Um ihre Behandlung zu verbessern, schlagen Wissenschaftlerinnen und Wissenschaftler des Max-Planck-Instituts für Intelligente Systeme, des Karlsruher Instituts für Technologie (KIT) und des Maastricht University Medical Center in den Niederlanden nun eine neue Methode vor.
Um Nervenzellen im Gehirn zu stimulieren, setzen sie
auf magnetoelektrische Nanopartikel, die nur rund 50 Nanometer groß
sind, also etwa 1000-mal kleiner als ein menschliches Haar. Die winzigen
Teilchen bestehen aus zwei Metalloxiden und können ein magnetisches
Signal in ein elektrisches Signal umwandeln.
Neurobiologen und Neurochirurgen des Maastricht University Medical Center injizierten die Partikel gezielt in die Gehirne von Mäusen. Als sie die Mäuse anschließend einem Magnetfeld aussetzten, erzeugten die Partikel ein elektrisches Feld und stimulierten die umliegenden Neuronen. Sie brachten die Neuronen also zum Feuern, ähnlich wie dies gängige Geräte zur tiefen Hirnstimulation (DBS, kurz für Deep Brain Stimulation) tun.
Nerven werden ähnlich aktiviert bei der normalen Hirnstimulation
Umgangssprachlich Hirnschrittmacher genannt, bestehen solche Geräte
aus Elektroden, die tief ins Gehirn führen. Sie sind durch Drähte mit
einem Impulsgeber verbunden, der auf Höhe der Brust unter die Haut eines
Parkinsonpatienten implantiert wird und elektrische Impulse an die
Zielregion im Gehirn abgibt.
Die elektrischen Impulse reduzieren die charakteristischen Symptome wie Zittern, Muskelsteifigkeit, Verlangsamung der Bewegungen und gestörte Haltungsstabilität. Bei der Operation, mit der die Elektroden im Gehirn implantiert werden, sind die Patienten allerdings dem Risiko von Blutungen und Infektionen ausgesetzt. Die Injektion winziger Partikel, die Teile des Gehirns drahtlos stimulieren, könnte eines Tages zu einer Behandlung von Parkinson werden, für die keine größere Operation nötig ist.
„Die wichtigste Erkenntnis unserer Forschung ist, dass wir die
Hirnaktivität ähnlich wie bei einem normalen DBS verändern können“, sagt
Kristen Kozielski, die bis vor kurzem am Max-Planck-Institut für
Intelligente Systeme forschte und nun eine Gruppe am KIT leitet.
„Ähnlich wie beim kabellosen Aufladen eines modernen Smartphones gibt es keine Kabel, die die Nanoelektroden mit dem Impulsgeber verbinden. Das macht die Anwendung im Inneren des Gehirns weniger invasiv und sicherer.“
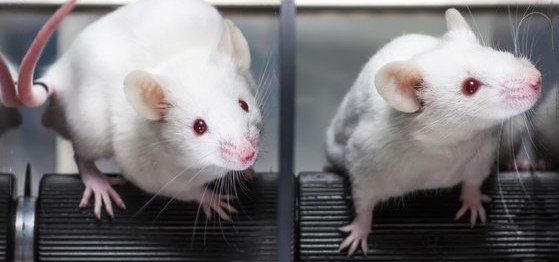
In Tests liefen die Mäuse schneller
Für die Tests der Technik injizierten Ali Jahanshahi und sein Team am medizinischen Zentrum der Universität Maastricht die Partikel in die subthalamische Hirnregion von Mäusen ein. Diese Region spielt bei der Bewegungskontrolle von Säugetieren eine Schlüsselrolle und ist daher ein Ziel für die tiefe Hirnstimulation bei Parkinsonerkrankten. Wie sich die Stimulation der Nervenzellen über die Nanoelektroden auf das Verhalten der Mäuse auswirkt, untersuchten die Forschenden in verschiedenen Verhaltenstests. So bewerteten sie das Laufverhalten der Mäuse in einem automatisierten Testaufbau namens 'CatWalk', während sie die Tiere einem Magnetfeld aussetzten. Auf diesem berührungsempfindlichen Laufsteg werden die Tiere mit einem computergestützten Kamera-Tracking-System beobachtet. Dabei zeigte sich, dass die Mäuse im Magnetfeld signifikant schneller wurden. „Ihre Gliedmaßen bewegten sie häufiger, die Schrittlänge wurde größer, während andere Bewegungsparameter wie das Gleichgewicht nicht beeinträchtigt wurden“, sagt Ali Jahanshahi weiter. „Die Analyse des Gehirns der Tiere ergab, dass ein möglicher Mechanismus hinter diesem spezifischen Verhaltenseffekt die Aktivierung mehrerer miteinander verbundener Hirnareale sein könnte, die gemeinsam das Erregungsverhalten regulieren.“
Weitere Untersuchungen zu Wirkung, Toxizität und Stabilität
In dieser ersten Studie verwendeten die Forschenden gesunde Mäusen,
um die Sicherheit und Funktionalität der Nanopartikel zu bewerten. Ob
sich durch die Nervenstimulation über Nanoelektroden tatsächlich die
Krankheitssymptome lindern lassen, wird das Team nun an
parkinsonerkrankten Mäusen untersuchen. Ehe die Nanotherapie in
klinischen Studien erprobt wird, müssen die Forschenden auch noch
weitere Daten zur Toxizität und zur Stabilität der Nanopartikel sammeln.
„Über die Dauer unserer Untersuchungen reagierte das Nervengewebe ähnlich wie auf die herkömmlichen Elektroden“, sagt Kristen Kozielski. Während der maximalen Untersuchungsdauer von sieben Wochen, bewegten sich die Nanopartikel zudem nicht von der Injektionsstelle fort und wurden auch nicht abgebaut. Ob das auch über einen längeren Zeitraum der Fall ist, wollen die Forschenden ebenfalls in weiteren Studien klären.
Metin Sitti, Direktor der Abteilung für Physische Intelligenz am Max-Planck-Institut für Intelligente Systeme verspricht sich jedenfalls viel von der Forschung: „Drahtlose medizinische Geräte könnten in naher Zukunft die Medizin revolutionieren, indem sie eine minimal-invasive, implantierbare, lokale und effektive Behandlung vieler Krankheiten ermöglichen. Die Studie ist ein erster Schritt in diese Richtung.“
Quelle: Max Planck Gesellschaft, LB/PH
Foto: Adobe Stock Mäuse auf dem Catwalk: Tiere, in deren Gehirnen Nervenzellen über magnetisch angesteuerte Nanoelektroden stimuliert wurden, liefen bei einem solchen Experiment auf einem Laufrad deutlich schneller.